小分子偶聯藥物(Small molecule-drug conjugates,SMDC)的組成及作用機制介紹
Small molecule-drug conjugates,SMDC是與ADC藥物極為相似的小分子偶聯藥物,SMDC對于大家而言相對陌生,布局企業的數量以及靶點的豐富程度與ADC也相差甚遠。通俗來說,SMDC與ADC,甚至PROTAC都有相似的組成,均是由靶向分子、連接臂(Linker)和效應分子(細胞毒、E3連接酶)構成。而SMDC與ADC直接的區別就是靶向分子,ADC使用生物抗體作為藥物靶向定位,SMDC則是采取小分子定向。在ADC的制備中,藥物載荷與抗體之比通常不能確定,采用定點偶聯技術可以實現相對準確的藥物抗體比(DAR),而SMDC的小分子靶向配體和藥物載荷通常都會有準確值。
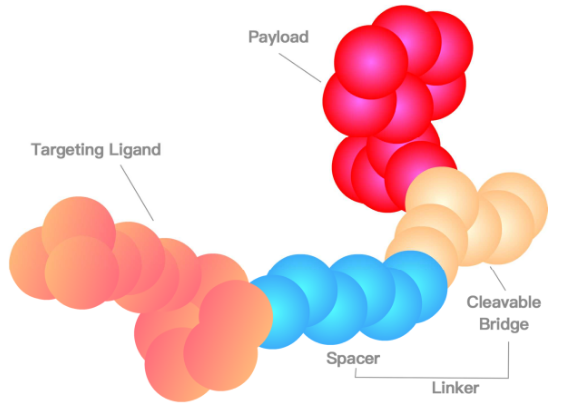
SMDC具有自己的優勢。SMDC藥物由小分子組成,容易控制合成工藝和成本,相較于抗體**,工業化操作簡單;其次,SMDC理論上不會具有免疫原性,安全性控制更容易實現;并且,SMDC的分子量相較于ADC要低很多,從而在實體瘤中能夠具有更好的細胞通透性以及更好的體外和體內穩定性。然而,正是因為SMDC在分子構成上也與PROTAC類似,同樣面臨難以解決的口服制劑問題。
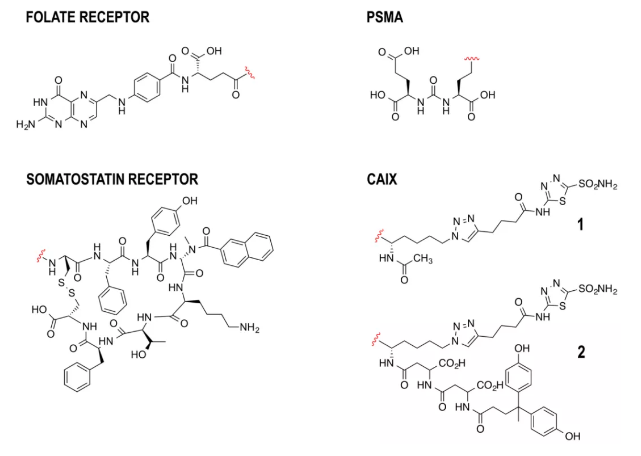
1. 靶向配體(Targeting ligand)
靶向配體發揮的作用類似ADC中的抗體部分。SMDC配體設計需要考慮結合親和力、靶標選擇性和化合物的大小。
SMDC的配體大小也不容忽視,由于通常已經確定了合適藥代動力學的毒性載荷和接頭綴合物,SMDC分子的大小會通過不同的機制影響藥物向實體瘤的遞送,包括滲透性。同時,低分子量的SMDC也容易被代謝,因為脫靶的**通常能夠及時從體內排泄,從而減少正常細胞中的不良毒性。
SMDC的配體選擇并沒有ADC抗體那樣直接,對于篩選合適的配體難度較大,因此,SMDC**靶標多樣性并不是很豐富。
2.Linker
為了保留靶向配體的活性和載荷功效,應精心設計接頭,以優化藥物釋放、藥代動力學和藥效學性質等功能。
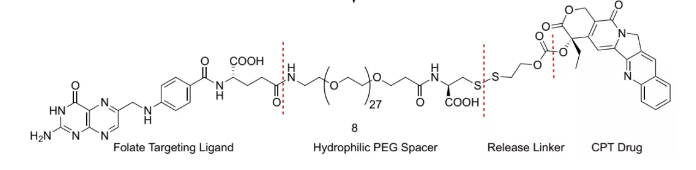
spacer通常用作靶向配體和可裂解臂之間的連接物,并且對于SMDC維持受體結合**重要。不合適的spacer可導致不必要的分子內締合的結合親和力降低。此外,spacer的另一功能是改善SMDC的親水性。以大化膜的通透性和受體親和力。使用水溶性間隔基,例如多糖、親水性氨基酸、PEG和肽聚糖,賦予SMDC改善的親水性潛力。同時,如果沒有基于受體的內吞作用,極性綴合物很難通過細胞膜滲透。然而,spacer的特征尚不清楚,在某些情況下,剛性結構比柔性結構要好
**的SMDC活性取決于可裂解臂(Release Linker)在穿透目標細胞后,能夠以預測的裂解位點和速率從SMDC母體釋放細胞毒**。因此,與ADC**一致,SMDC**同樣要求在體內循環過程中的**穩定。SMDC中使用兩種類型的觸發方法:①使用基于二硫鍵的連接子是成功的方法之一;②是基于體內pH環境的差異,設計對靶細胞pH值的裂解子,如乙縮醛可以在體內酸性環境下水解。
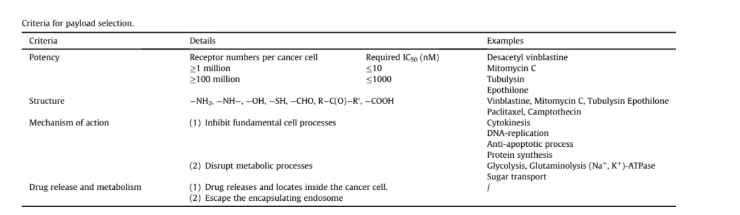
3.載荷
小分子載荷或活性藥物同樣是SMDC的核心部分,對于載荷的選擇也與ADC藥物一樣,需要考慮多個方面。**,載荷在SMDC分子的釋放速率;其次,載荷的細胞活性、胞內的穩定性等,比如選擇低摩爾或亞摩爾的載荷;三,高結合力以及對抗外排的潛力。總的來說,可以參考以下幾項標準:
 4.SMDC作用機制
4.SMDC作用機制
在作用機制上,SMDC和ADC**也是高度一致。以靶向葉酸受體的SMDC**為例,SMDC**并不能像正常細胞吸收葉酸那用通過還原的葉酸載體通道進入細胞,而是像ADC**一樣,通過與高親和力的葉酸受體結合,以內吞形式進入細胞,然后裂解釋放細胞毒性分子,發揮殺傷作用,而葉酸受體再次循環至細胞表面。
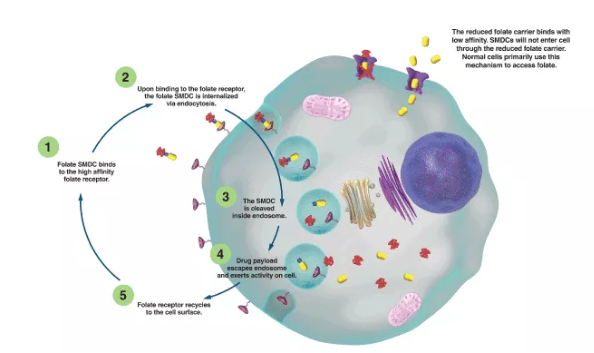
可以看出,SMDC藥物與ADC藥物無論是在分子構成、作用機制甚至相關藥物要求方面等都有著諸多共通。因此,在SMDC藥物的研發過程中,參考一些ADC藥物的研發經驗和方法,說不定也可以獲益良多。
溫馨提示:以上內容來源于西安齊岳生物小編axc,如有侵權請聯系我們,西安齊岳生物科技有限公司供應的產品僅用于科研,不能用于其他用途。




 齊岳微信公眾號
齊岳微信公眾號 官方微信
官方微信 庫存查詢
庫存查詢